一例人狂犬病病例的病毒分离和系统鉴定
摘要:
目的 对2013年武汉市新发生的一例疑似狂犬病死亡病例的人脑组织进行病毒分离及鉴定。
方法 采用直接荧光抗体法(DFA)及ELISA法检测狂犬病毒(rabiesvirus,RABV)抗原;提取病毒RNA,设计12对引物,分段扩增全基因组,克隆后测序,应用DNASTAR软件包中的MegAlign模块对基因所编码的氨基酸进行对位分析;Clustal X 1.83软件和GENEDOC软件用于序列比对;Mega4.1软件以Kimuratwo-parameter模型邻位相连法(Neighbor-Joining,NJ)构建系统进化树(Bootstrap-1000),并与国内外疫苗株及近期湖北省及周边地区分离的代表性街毒株进行同源性分析。
结果 分离的街毒株13WH10的RABV抗原呈阳性;13WH10街毒株基因组全长11,924bp,属基因Ⅰ型狂犬病毒;13WH10与湖北省及周边街毒株处于同一亚群,与CTN-1疫苗株及东南亚地区的街毒株同源性较高,高于欧美国家疫苗株。
结论 成功对武汉市2013年新发生的一例疑似狂犬病死亡病例的人脑组织进行病毒分离及鉴定;CTN-1与RABV国内分离株同源性较高,系统进化关系较近,提示采用CTN-1疫苗株生产的狂犬病疫苗可有效预防中国狂犬病的流行。
关键词:狂犬病毒;街毒株;同源性分析
狂犬病是由狂犬病病毒(rabies virus, RABV)引起的人兽共患性传染病,病死率几乎为100%。我国属狂犬病高发国家,家犬是RABV的主要宿主和传染源[1]。目前国内分离的人源狂犬病病毒街毒株数量较少[2-3],其中仅Ming等[4]对人源街毒株HN10进行过全基因组测序及特征分析。
尸检是狂犬病确诊的方法之一,而与国外相比,国内狂犬病患者或疑似狂犬病患者死亡后,尸检和病因鉴定较少。本研究对2013年武汉市新发生的一例疑似狂犬病死亡病例取尸体脑组织进行实验室诊断,采用直接荧光抗体法(DFA)和ELISA法检测RABV抗原,对分离的病毒全基因组进行测序,并在分子水平与国内外的疫苗株及近期湖北省及周边地区的街毒株进行遗传特征差异和系统进化分析,现将结果报道如下。
1 材料与方法
1.1 病史资料 本案例属于一犬咬多人。死者邱某,男,37岁,于2013年3月12日在武汉市青山区建设十路被犬咬伤下嘴唇,Ⅲ级暴露;同行者石某,男,48岁,手臂也被此犬咬伤,Ⅲ级暴露。暴露后二人马上“肥皂水冲洗,挤压出血”处理伤口,伤人犬已被处死[5]。
2013年3月26日晚(暴露后第15天)邱某突发呕吐、舌头打卷、吐口水、怕风恐水,截止发病时已接种疫苗4针;后转至武汉市急救中心救治,3月29日9时45分,邱某死亡。石某分别于暴露后第0、3天各接种2针,第7、14、28天各接种1针,共接种7针狂犬病疫苗,至今存活。二者均未注射抗血清或免疫球蛋白。同济法医学司法鉴定中心分离死者邱某人脑组织,委托武汉生物制品研究所有限责任公司狂犬病检测中心(以下简称“本中心”)进行检测,分离的狂犬街毒株命名为13WH10。
1.2 实验动物 SPF级1日龄昆明乳鼠5只,由武汉生物制品研究所有限责任公司实验动物中心提供,合格证号:SCXK(鄂)2008-0003。
1.3 主要试剂 RABV抗原检测试剂盒(双抗体夹心ELISA)由武汉生物制品研究所有限责任公司提供,异硫氰酸荧光素(FITC)标记的抗RABV核蛋白单克隆抗体购于美国Millipore公司,TRIzol试剂和superscript ⅢReverse Transcriptase购自美国lnvitrogen公司,MMLV反转录酶、EXTaq酶和pMDl9-T simple vector 试剂盒购于日本TAKARA,凝胶回收试剂盒QIAquick Gel Extraction Kit购于德国Qiagen公司。
1.4 引物设计和合成 根据人用狂犬病疫苗PV株(Genbank accession no. M13215)基因组序列,并参考表1中RABV株的保守区序列,使用PrimerPremier 5软件设计12对引物,见表2,覆盖全基因组序列。
1.5 RABV抗原鼠脑传代 取死者脑样品海马回部位组织 0.3 g,加入含青霉素(500 U/ml)及链霉素(2 mg/ml)的PBS(pH 7.4),研磨制备成10%的脑悬液,颅内接种1日龄昆明乳鼠5只,每只10μl,连续21天观察乳鼠发病情况[6] 。
1.6 RABV抗原的检测
1.6.1 DFA检测 取死者脑样品海马回部位组织及RABV传代乳鼠脑组织印片于载玻片上,冷丙酮室温固定30min,干燥后加入FITC标记的抗RABV核蛋白单克隆抗体(1:60稀释),37℃湿盒孵育1 h,PBS漂洗3次,晾干后滴加60%甘油,盖玻片封片,于荧光显微镜下观察[7]。
1.6.2 双抗体夹心ELISA检测 RABV抗原检测试剂盒检测死者脑组织和上述接种死者脑海马组织悬液后发病的乳鼠脑组织悬液中的RABV抗原[8]。以正常乳鼠脑组织作为阴性对照,CVS-24标准攻击毒接种的乳鼠脑组织作为阳性对照。
在阴性对照孔A450值 < 0.1、阳性对照孔A450值 > 0.5的条件下,样品A450值 > 0.4 判定为RABV抗原阳性。
1.7 全基因组分段PCR扩增
用TRIzol试剂提取病毒RNA,以pd(N)6为引物,逆转录合成病毒基因组cDNA。以逆转录产物cDNA为模板,用表2中的引物进行PCR扩增。反应体系为:TAKARA Ex Taq 0.26 ul,10×Ex Taq buffer 5 ul,dNTP Mixture 4 ul,模板1 ul,正反向引物各1 ul,去离子水37.74 ul,共50ul。反应条件:94℃预变性5 min;94℃ 30 s,55℃ 30 s,72℃ 2 min,30个循环;72 ℃延伸10 min。扩增产物经1%凝胶电泳鉴定,然后用QIAquickGel Extraction Kit 回收。
表1. 本研究中参考的狂犬病街毒株及疫苗株
Table 1. RABV street strains and vaccine strains refered in thisstudy
|
病毒株 |
宿主/用途 |
分离地 |
分离时间 (年) |
Gene序列号
|
|
|
|
标准攻击毒株 |
法国 |
1882 |
GQ918139 |
GQ918139 |
|
ERA |
兽用疫苗株 |
美国 |
1935 |
EF206707 |
EF206707 |
|
SAD B19 |
人用疫苗株 |
美国 |
1935 |
M31046 |
M31046 |
|
RC-HL |
人用疫苗株 |
日本 |
- |
AB009663 |
AB009663 |
|
HEP-Flury |
人用/兽用疫苗株 |
美国 |
1939 |
AB085828 |
AB085828 |
|
PV |
人用疫苗株 |
法国 |
1882 |
M13215 |
M13215 |
|
CTN-1 |
人用疫苗株 |
中国山东 |
1956 |
FJ959397 |
FJ959397 |
|
3aG |
犬 |
中国北京 |
1935 |
AF155039 |
L04522 |
|
HN10 |
人 |
中国湖南 |
2007 |
EU643590 |
EU643590 |
|
HN06 |
犬 |
中国湖北武汉 |
2005 |
- |
DQ849062 |
|
WH5 |
犬 |
中国湖北武汉 |
2005 |
EU159380 |
DQ849061 |
|
QC |
人 |
中国湖北蕲春 |
2006 |
EU159377 |
DQ849063 |
|
WHQS |
犬 |
中国湖北武汉 |
2007 |
- |
FJ602454 |
|
WHWD |
犬 |
中国湖北武汉 |
2007 |
- |
FJ602455 |
|
WHYF |
犬 |
中国湖北武汉 |
2007 |
- |
FJ602456 |
|
WH11 |
驴 |
中国湖北武汉 |
2011 |
JQ647510 |
JQ647510 |
|
04030PHI |
人 |
菲律宾 |
2004 |
EU086205 |
EU086155 |
|
H-08-1320 |
人 |
斯里兰卡 |
2008 |
AB569299 |
AB569299 |
|
NNV-RAB-H |
人 |
印度 |
2006 |
EF437215 |
EF437215 |
|
Hum-Trans-IND |
人 |
德国(来自印度) |
2004 |
AY956319 |
AY956319 |
|
8743THA |
人 |
泰国 |
1983 |
EU293121 |
EU293121 |
|
8764THA |
人 |
泰国 |
1983 |
EU293111 |
EU293111 |
注:RC-HL株未查到确切分离时间
1.8 PCR扩增产物克隆和序列测定 将PCR回收纯化产物与pMDl9-Tsimple vector连接,转化感受态大肠埃希菌DH5a(pMDl9-Tsimple vector自带),筛选鉴定阳性克隆,提取质粒,送南京金斯瑞公司测序。
1.9 序列分析 应用DNAStar软件包中MegAlign模块对基因所编码的氨基酸进行对位分析;ClustalX 1.83软件和GENEDOC软件用于序列比对;MEGA 4.1软件以Kimura two- parameter模型邻位相连法(NJ)构建系统进化树(Bootstrap-l000),并与国内外疫苗株及近期湖北省及周边地区分离的代表性街毒株(表1)进行同源性分析。
表2 狂犬病病毒街毒株13WH10全基因组测序引物
Table 2. Primersused for sequencing of the complete genome of rabies virus isolate 13WH10
|
|
Sequence (5’-3’) |
|
Length (bp) |
Position |
|
RV1-F |
ACGCTTAACAACAAAAYCATAGAAGAAGCAG |
|
1012 |
1-1012 |
|
RV1-R |
AAAGTGAATGAGATTGAACACGTGACCAAC |
|
|
|
|
RV2-F |
GCTTACGAAGATTGCTCAGGACTGGTATCA |
|
951 |
764-1714 |
|
RV2-R |
TTAAGGCCAGATGGTTTTCCGTCATCCAGC |
|
|
|
|
RV3-F |
TAACACCCCTCCTTTTGAACCAT |
|
1005 |
1484-2488 |
|
RV3-R |
GTGGTGTTGCCTGTTTTTTTCAT |
|
|
|
|
RV4-F |
CAGGCAACACCACTGATAAAATGAA |
|
678 |
2476-3153 |
|
RV4-R |
TCTCTCCTCCAGAGGTAAACAAGTG |
|
|
|
|
RV5-F |
TGGTGTATCAACATGAATTC |
|
1097 |
3000-4096 |
|
RV5-R |
ACCCATGTTCCG TCCATAAG |
|
|
|
|
RV6-F |
TGTGACATTTTCACCAATAGTAGAGGGAAG |
|
1419 |
3937-5355 |
|
RV6-R |
TTTTTTTCTCGACTGAAAAGCGTAGATGAC |
|
|
|
|
RV7-F |
TCCAAGAACTGATACCAAAGGTGGTGGACA |
|
1396 |
5115-6510 |
|
RV7-R |
ACATCCGTACACAAAAACCAGGTCATGTAT |
|
|
|
|
RV8-F |
AGAGGGCAGAGAAGTTTAGACCTCTTATTC |
|
1360 |
6341-7700 |
|
RV8-R |
CGGTATATAGAAAGGGCATTCCTMGATATG |
|
|
|
|
RV9-F |
TTAYGCCAAAARGGCTGGAGTCTGGTCAGC |
|
1400 |
7501-8900 |
|
RV9-R |
CCTTTTAGAGGGCCTCGTGAAAAAAATGAC |
|
|
|
|
RV10-F |
GCAGATCTCTTAAGAGAGATTTCTTGGGGG |
|
1410 |
8701-10110 |
|
RV10-R |
TCGTAGGTTAGCTCTCATGCTCTTAGATAR |
|
|
|
|
RV11-F |
CTATTTTGTGTTACCTCCARCATGTGCTGC |
|
1110 |
9911-11020 |
|
RV11-R |
GGAGATATAGYTCAGATGAAAAAGACGAGG |
|
|
|
|
RV12-F |
CGGATAACACTkTTGATGTCTGACTTCGCA |
|
1094 |
10831-11924 |
|
RV12-R |
ACGCTTAACAAAAAAACAATAAAGACAAAAA AAATAATCAAACAACCAGAGGTTCTG |
|
|
|
2 结 果
2.1 乳鼠发病情况 1日龄昆明乳鼠接种死者脑组织悬液12d后开始表现出拱背、耸毛、转圈运动、麻痹等狂犬病症状,并于发病后2~3d内全部死亡。
2.2 RABV抗原检测结果
2.2.1 DFA法 荧光显微镜下观察显示,死者脑组织样本均可见不同形状和大小的绿色荧光颗粒,见图1,表明RABV抗原阳性。
2.2.2 ELISA法 检测结果显示,死者脑组织样本A450值为1.616,阳性对照2.346,
阴性对照0.087,表明该样本RABV抗原阳性;5只传代乳鼠脑组织的A450值分别为2.127、2.556、2.345、2.170、2.237,阳性对照2.259,阴性对照0.065,表明该样本的RABV可在乳鼠脑组织中传代。
A:
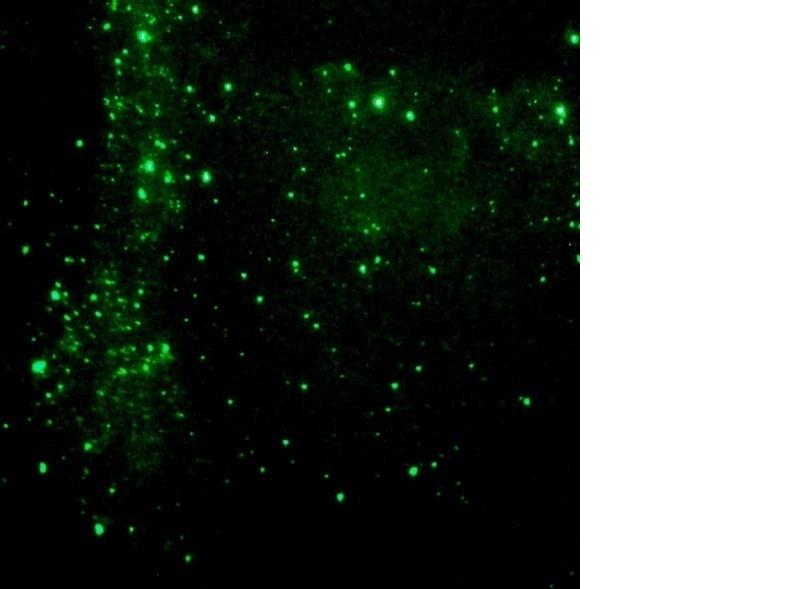
B:

![]()



A:病人脑组织; B:CVS-24标准攻击毒株接种乳鼠脑组织;
C:传代的乳鼠脑组织; D:正常乳鼠脑组织。
图1 人脑组织样本 RABV DFA检测(40×)
Fig.1 DFA detection of RABV antigen in human brain tissue sample(40×)
2.3 13WH10街毒株全基因组测序结果分析 13WH10街毒株基因组全长11,924bp,与Genbank公布的其他狂犬病病毒基因组类似。3’端58个核苷酸先导序列,N基因(59-1483),P基因(1486-2475),M基因(2481-3283),G基因(3289-5355),L基因(5380-11,854),5,端70个核苷酸尾巴。5种结构蛋白CDS编码区序列如下:1353nt N 蛋白(71-1353),894 nt P 蛋白(1515-2408),609 nt M 蛋白(2496-3104),1575ntG 蛋白(3316-4890),6385nt L蛋白(5407-11793)。
2.4 13WH10街毒株N、G基因与国内外疫苗株及近期湖北省周边地区分离的代表性街毒株的同源性分析 13WH10分离株N基因开发阅读框(ORF)全长为1353bp,编码450个氨基酸的核蛋白。利用核苷酸序列推导的氨基酸序列构建进化树见图2,图中显示,13WH10分离株与湖北省内分离株QC、WH11等亲缘关系较近,处于同一亚群。13WH10与近年在湖北省及周边地区分离的代表性街毒株N 基因核苷酸序列及推导的氨基酸序列的同源性分别为 88.8%~99.6% 和 99.1%~100%,国内外人用、兽用疫苗株N 基因核苷酸序列及推导的氨基酸序列的同源性分别为 86.2%~89.5% 和95.6%~99.1%,东南亚分离街毒株N 基因核苷酸序列及推导的氨基酸序列的同源性分别为 86.6%~88.9%和 98%~99.3%。

![]() 注: 13WH10为本研究分离株
注: 13WH10为本研究分离株
图2 狂犬病病毒13WH10株 N 基因系统进化树分析
Fig.2 Phylogenetic tree was constructed using the nucleotidesequences of nucleoprotein gene of rabies virus isolate 13WH10 (marked with redtriangle)
G 基因ORF全长1575bp,编码524个氨基酸,利用核苷酸序列推导氨基酸序列构建进化树(图3),结果显示,13WH10与湖北省内分离株WHWD、QC、WH11等亲缘关系较近,处于同一亚群。13WH10与近年在湖北省及周边地区分离的代表性街毒株G 基因核苷酸序列及推导的氨基酸序列的同源性分别为87.8%~99.6%和99%~99.6%,国内外人用、兽用疫苗株G 基因核苷酸序列及推导的氨基酸序列的同源性分别为82.2%~87.5% 和 87.8%~94.7%,东南亚国家分离街毒株G 基因核苷酸序列及推导的氨基酸序列的同源性分别为83.8%~87.6%和92.6%~94.5%。
N、G基因的进化树分析均显示,13WH10与CTN-1同源性高,与国外疫苗株相比,与东南亚地区的街毒株同源性较欧美国家高;而中国北京分离的3aG株与国外的疫苗株同源性较高,处于另一亚群。

![]() 注: 13WH10为本研究分离株
注: 13WH10为本研究分离株
图3 狂犬病病毒13WH10株 G 基因系统进化树分析
Fig.3 Phylogenetic treewas constructed using the nucleotide sequences of glycoprotein gene of rabiesvirus isolate 13WH10 (marked with red triangle).
3 讨 论
3.1 本病例接种疫苗仍造成死亡的原因 造成本病例死亡的主要原因是“未注射抗血清”。
WHO和我国卫生部颁布的狂犬病暴露后处置规范明确规定,被疯动物Ⅲ级致伤者必须彻底清洗伤口、特异性抗体制剂联合疫苗接种进行暴露后治疗[9]。疫苗接种即使使用高质量的细胞培养疫苗,初次免疫后的有效中和抗体也要在免疫后7d左右产生,疫苗免疫后尚未产生中和抗体的这一“空缺”时间,只有应用特异性抗体制剂才能予以填补,这一重要问题经过人体观察和动物实验已得到充分证实[1,10]。本案例中邱某的暴露部位是下嘴唇,石某的暴露部位是手臂。狂犬病病毒的入侵部位与发病率密切相关,暴露部位距离大脑越近,潜伏期越短,发病率越高,Dean等[11]将狂犬病病毒Flury Lep株接种狐狸颈部和腿部肌肉的研究得到了证实。此外,二人进行伤口处理时采用的“挤压出血”方法,不符合WHO和我国卫生部颁布的狂犬病暴露后处置规范,应立即用肥皂水、清洁剂、碘或其他对狂犬病病毒有效的杀灭物质彻底冲洗伤口至少15分钟,随后再进行免疫球蛋白等处理。及时彻底清洗伤口、接种狂犬病疫苗与抗血清能有效预防暴露后狂犬病的发生[9]。挤压出血方法可能导致伤口破坏程度更严重,更易使狂犬病毒进入伤口周围细胞及神经组织。
3.2 本病例确诊为狂犬病的依据
根据《中华人民共和国卫生行业校准:狂犬病诊断标准》(卫生部2008年版),狂犬病的临床诊断病例必须加上至少一项实验室检测的阳性结果才可确诊。DFA(直接免疫荧光法)是WHO推荐的实验室检测狂犬病的金标准[7]。双抗体夹心ELISA法以核蛋白单克隆抗体为基础,具有较高的敏感性,操作简便、结果易于判定,广泛应用于狂犬病的辅助诊断。上述脑组织样品用DFA和双抗体夹心ELISA两种方法鉴定,均为狂犬病病毒抗原阳性,因此本病例可确诊为狂犬病。后续的病毒分离和全基因组测序分析等方法则可进一步确证本病例的诊断。
3.3 狂犬病病毒13WH10株的系统进化特征
本研究成功从人脑样品分离出狂犬病病毒13WH10株,并完成全基因测序及特征分析。目前,已有多株疫苗株SAD B19,CTN-1,RC-HL,RV-97等及街毒株HN10,WH11,RRV-ON-99-2,KGH等完成全基因测序分析工作。上述大量研究及本研究结果显示,狂犬病病毒属基因组高度保守,存在大量与病毒在宿主体内繁殖扩增相关的重要结构基序。13WH10与国内外疫苗株及周边地区街毒株的同源性分析结果显示,各病毒株基因组同源性较高,说明狂犬病病毒具有较高的遗传稳定性。疫苗株与其系统进化相近的街毒株大多存在少量核苷酸替换,良好的疫苗株应该与流行区域的街毒株具有高水平的同源性。
N、G 基因的系统进化树结果均显示,13WH10与湖北省及周边街毒株(WH11,QC等)处于同一亚群,与CTN-1同源性高,与国外病毒株相比,其与东南亚地区的病毒株同源性较欧美国家高;而中国北京分离的3aG株与国外的疫苗株同源性较高,处于另一分支。病毒株亲缘关系的密切程度,与病毒的分离地点、宿主来源等密切相关,分离地越近,宿主来源种属越接近,则同源性越高[12]。CTN-1与国内分离街毒株的同源性较高,系统进化关系也较近,提示采用CTN-1疫苗株生产的狂犬病疫苗能有效预防中国狂犬病的流行[13]。ZhangYZ等人认为,中国狂犬病街毒株可分为两大分支:大多数中国街毒株集中在一亚群,与CTN及东南亚国家分离株高度同源,而另一部分中国街毒株与3aG及国外疫苗株同源性较高,可归为另一亚群[3]。3aG株及国外疫苗株可能与我国数年前街毒株的流行趋势趋同。孟胜利等[14]的研究表明RABV存在着跨地域、跨宿主传播的现象。Fèvre EM等[15]的研究表明,野生动物和家养动物的贸易、迁移对病毒类疾病的传播有重要影响。
3.4 应倡导与狂犬病相关的尸检
由于传统观念或是其他因素,中国目前死亡病人的尸检率极低。20%的狂犬病人症状不典型,易误诊为其他脑炎,而脑炎病人的死因几乎都没有经过针对狂犬病的尸检进行确诊。狂犬病诊断的金标准是对脑组织进行特异性荧光抗体检测。因此,尸检后取脑组织的实验室检查是狂犬病确诊的最好方法。因供体携带狂犬病病毒通过角膜移植引起受体狂犬病死亡的病例已出现多起[16-17]。2004年美国一男子生前被蝙蝠咬伤,死后将肾脏、肝脏等移植给4位受者,4位患者均因狂犬病死亡[18]。虽然我国目前未报导因器官移植引发狂犬病的案例,但应当引以为戒:对与脑炎相关的各种死因,应逐步推广进行针对狂犬病的尸检鉴定,以使我国有关狂犬病的死亡人数统计更加准确可靠。
目前全球已发现14种基因型的RABV,新的基因型病毒还在不断发现。我国RABV的流行情况非常复杂且特殊,需在更大范围内系统地开展狂犬病的分子流行病学研究,分析RABV街毒株与疫苗株之间的关系、抗原性之间的差异、及时监测病毒株的变异情况,以及RABV在不同宿主之间的跨种传播和跨地区传播的模式。
参考文献:
[1] 俞永新主编,狂犬病和狂犬病疫苗(第二版)[M]. 北京:中国医药科技出版社, 2009.
Yu Yong-xin editor, Rabies and Rabies Vaccine (secondedition) [M] Beijing:Chinese Medical Science and Technology Press, 2009.
[2]Meng S L, Xu G L, Yan J X, et al. Molecular epidemiology and sequencing of the GLintergenic region of rabies viruses isolated in China[J]. Virologica Sinica, 2007, 22(1):26-33.
[3] Zhang Y Z, Xiong C L, Lin X D, et al. Genetic diversity of Chinese rabies viruses: evidence forthe presence of two distinct clades in China[J]. Infection, Genetics andEvolution, 2009, 9(1): 87-96..
[4]Ming P, Du J, Tang Q, etal. Molecular characterization of the complete genome of a street rabies virusisolated in China[J]. Virus research, 2009, 143(1): 6-14.
[5] 家具店老板被狗咬伤嘴唇打疫苗后仍发狂犬病身亡[OL]来自荆楚网( 2013-03-31) [2013-09-30]http://news.cnhubei.com/xw/sh/201303/t2522336.shtml
Furnitureboss died of rabies after vaccination, who was attacked by dog at lip. From
Jingchu network (2013-03-31)[2013-09-30] http://news.cnhubei.com/xw/sh/201303/t2522336.shtml
[6] ChhabraM, Mittal V, Jaiswal R, Malik S, Gupta M, Lal S: Development and evaluation
of an in vitro isolationof street rabies virus in mouse neuroblastoma cells as compared to conventionaltests used for diagnosis of rabies. Indian J Med Microbiol, 2007, 25: 263-266.
[7] Rudd RJ, Smith JS,Yager PA, Orciari LA, Trimarchi CV: A need for standardized rabies-virusdiagnostic procedures: effect of cover-glass mountant on the reliability ofantigen detection by the fluorescent antibody test. Virus Res, 2005, 111:83-88.
[8] XuG, Weber P, Hu Q, et al. A simple sandwich ELISA (WELYSSA) for the detection oflyssavirus nucleocapsid in rabies suspected specimens using mouse monoclonalantibodies[J]. Biologicals, 2007, 35(4): 297-302.
[9] World Health Organization. WHO expert consultation onrabies: first report[M]. World Health Organization, 2010.
[10] Cho H C, Lawson K F. Protection of dogs against death fromexperimental rabies by postexposure administration of rabies vaccine andhyperimmune globulin (human) [J]. Canadian Journal of Veterinary Research,1989, 53(4): 434
[11]Dean D J, Evans W M, McClure R C.Pathogenesis of rabies[J]. Bulletin of the World Health Organization, 1963,29(6): 803.
[12]SongM, Tang Q, Wang DM, Mo ZJ, Guo SH, Li H, Tao XY, Rupprecht CE, Feng ZJ,
Liang GD: Epidemiological investigations of human rabiesin China.BMC Infect Dis
2009, 9:210
[13]孟胜利,徐葛林,明平刚,等.狂犬病毒疫苗株CTN—l八代次N和G基因序列测定及分
析.中国人兽共患病学报,2007,23(4):327-332
Meng Sheng-li,Xu Ge-lin, Ming Ping-gang,etc. Sequences determination and analysis of therabies virus nucleoprotein and glycoprotein genes in CTN-1 strain of eightgenerations. CHINESE JOURNAL OF ZOONOSES, 2007,23(4):327-332.
[14]孟胜利,徐葛林,程满荣,等. 中国狂犬病毒遗传多样性分析.中国生物制品学杂志.2010,23(5):449-454.
Meng Sheng-li, Xu Ge-lin, Cheng Man-rong,etc. Analysis of Geneitc Diversity of Rabies Virus Isolates in China.Chin J Biologicals, 2010,23(5):449-454.
[15] FèvreEM, Bronsvoort BM, Hamilton KA, et al. Animal movements and the spread ofinfectious diseases. Trends Microbiol, 2006, 14(3):125-131.
[16]Human-to-humantransmission of rabiesvia cornealtransplant — Thailand.MMWRMorb Mortal Wkly Rep 1981;30:473-4.
[17] Gode GR,Bhide NK. Two rabies deathsaftercorneal grafts from one donor. Lancet1988;2:791.
[18] SrinivasanA, Burton E C, Kuehnert M J, et al. Transmission of rabies virus from an organdonor to four transplant recipients[J]. New EnglandJournal of Medicine, 2005, 352(11): 1103-1111.
- 上一篇:我国首例输入性裂谷热病毒全基因组序列测定完成 2016/7/25
- 下一篇:SIFIN Monoclonal Anti-Rabies, 2016/7/21
