荧光探针定量PCR技术原理及应用
荧光探针定量PCR技术原理及应用
PCR技术是通过对基因的选择性片段进行体外高效扩增,实现目的基因的检测。荧光探针定量PCR(FQ-PCR)是一种新的基因定量检测技术,国外文献多用“实时定量PCR(real time quantitative PCR)”或“TaqMan PCR(以美国PE公司商标命名) ”。该技术是在常规PCR基础上加入荧光标记探针,巧妙地把核酸扩增(PCR)、杂交及光谱技术结合在一起,从而实现了对目的基因的准确定量检测,正发展成为临床实验诊断的常规技术。
1.原理
FQ-PCR的工作原理[1-3]是利用Taq酶的5’ → 3’外切酶活性,在PCR反应系统中加入一个荧光标记的探针。该探针可与引物包含序列内的DNA模板发生特异性杂交,探针的5’端标以荧光报告基团FAM(6-羧基荧光素,荧光发射峰值在518mm处),靠近3’端标以荧光淬灭基团TAMRA(6-羧基四甲基诺丹明,荧光发射峰值在582nm处),两者之间构成能量传递结构。当探针保持完整时,5’端荧光报告基团所激发出的荧光信号被3’端淬灭基因吸收或抑制,不出现荧光信号变化。当PCR反应体系中有目的基因存在,就会扩增出特异核酸片段,荧光探针即会根据碱基配对的原理与之杂交。当PCR进入延伸(复制)期,Tap酶从引物3’端开始,随新链延伸沿DNA模板移动,当移动到探针结合的位置时,其5’→ 3’端外切酶活性作用,将探针切断(切口平移效应)。荧光报告基团和淬灭基团间的能量传递结构被破坏,淬灭基团的淬灭作用被解除,荧光报告基团的荧光信号释放出来(图1)。PCR反应每复制一个特异核酸片段,就有一个探针被切断,伴随一个荧光信号的释放。由于被释放的荧光基团数目和PRC产物是一对一的关系,因此用荧光检测技术检测出的荧光信号有无或强弱,即代表扩增产物有无或多少。由于荧光信号是代表扩增产物的有效特异信号,无需进行有效和无效信号分离,实现了仪器实时检测(图2),为新的PCR定量原理创造了条件。
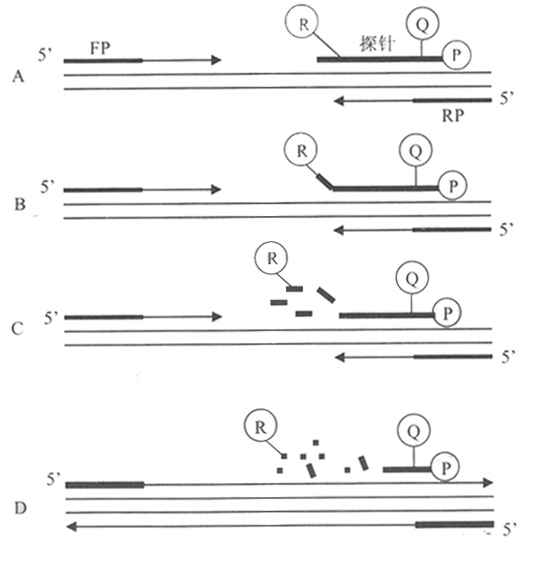
图1.TaqMan PCR反应模式
(A)聚合反应:(B)链置换;(C)裂解;
(D)聚合完成(R:FAM;Q:TAMRA;FP:上游引物;RP:下游引物)
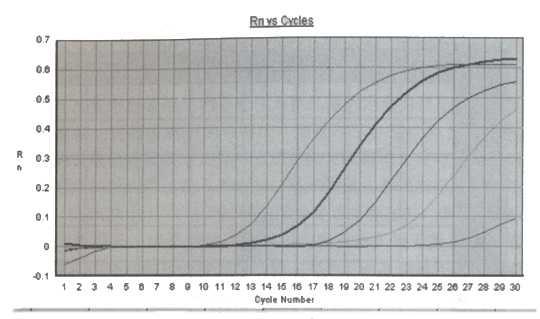
图2.FQ-PCR实时动力学曲线
ABI公司首先根据上述原理研制了ABI 7700 等系列定量PCR仪,在PCR反应中设置标准模板系列(一般5~7个标准浓度)反应管和空白对照管。通过实时检测反应管中的荧光信号,计算出RQ+、RQ-、△RQ。RQ+代表样品管荧光报告基团发光强度与淬灭基团发光强度的比率,RQ-代表空白管中二者的比率,△RQ(△RQ = RQ+-RQ-)代表PCR过程中荧光信号变化量。当荧光信号增强到某一阈值(根据荧光信号基线的平均值和标准差,计算出以99.7%的置信度大于平均值作为阈值)时,标准模板反应管所用的循环次数(Ct值)就被记录下来。Ct值与标准模板数量的对数值之间有严格的线性关系[3],利用系列标准模板的Ct值,制成标准曲线(图3),根据待测样品的Ct值,就可在标准曲线中确定待测样品起始的DNA数量。根据数据处理,即可得出定量结果。探针设计一般应符合以下条件[2]:①探针长度应在20~40个碱基左右,以保证结合的特异性。②GC碱基含量在40%~60%,避免单核苷酸序列的重复。③避免与引物发生杂交或重叠。④探针与模板结合的稳定程度要大于引物与模板结合的稳定程度,因此探针的Tm值要比引物的Tm值至少高出5℃。另外,探针的浓度,探针与模板序列的同源性,探针与引物的距离都对实验结果有影响。

图3.FQ-PCR 标准曲线
2. 技术特点
2.1 封闭状态下检测,避免了扩增产物污染而致的假阳性
传统PCR于反应结束后取出反应液,通过电泳染色和紫外仪观察结果。扩增产物在开放状态下分析,对实险室的污染是不可避免的。因污染而导致假阳性,成为PCR临床实验诊断技术应用一个难以逾越的障碍。FQ-PCR在全封闭状态下实现PCR扩增和产物分析,完全杜绝了扩增产物污染而导致的假阳性。至于样品间的污染,无论从目的基因的数量、浓度还是颗粒大小分析,都比较容易控制。我国PCR临床应用出现问题,产物污染所致假阳性是主要原因之一。
2.2 基因的定量检测,扩展了临床应用空间
传统PCR对基因的检测只能定性,不能定量主要是由扩增产物积累的动力学所决定的:①PCR产物在扩增过程中呈指数积累,当产物增加到一定程度,产物就停止了指数积累。不同起始模板,其指数增长期所用的循环是不同的,因此,不同数量基因的样品在同一循环次数中积累的产物不能作为样品基因定量的依据;②PCR产物积累到一定程度就不能再增加,再进入平台期。为了扩大PCR检出的灵敏度通常要增加循环次数,循环次数增加使得样品目的基因含量高的反应管已进入平台期,终产物量并不代表样品目的基因含量;③PCR反应的管间扩增效率差异总是存在的,既然PCR产物呈指数增长,由扩增效率差异引起的产物扩增差异也呈指数积累,增加循环次数势必增加终产物的差异,而减少循环次数又降低了检测的灵敏度。FQ-PCR采用实时检测,使所有含有不同数量的目的基因均在同一条件(达到荧光阈值)下进行分析,因而更具有可比性。而且,这一条件处于扩增产物指数积累初期,合成产物所需的dNTP、酶、离子均处于饱和的最佳状态,所以FQ-PCR循环参数与起始模板间有良好的线性关系(相关系数>0.95),实现了极为精确的基因定量检测。
2.3 光谱技术进一步提高了灵敏度
FQ-PCR 技术已用于单细胞基因诊断,灵敏度已达到极限水平,即检测单拷贝基因,而传统PCR是不易做到的。灵敏度提高得益于光谱技术。
2.4 荧光探针杂交,进一步提高了特异性
PCR 扩增中常会出现非特异性扩增和引物二聚体,从而影响了对特异电泳带的判断。FQ-PCR通过特异性探针杂交信号检测PCR扩增产物,相当于PCR反应过程中自动完成了Southern杂交,进一步提高目的基因检测的特异性。
2.5 扩增与自动分析一体化,检测更加简便和快速
FQ-PCR通过计算机和分析软件,使PCR扩增、产物检测和定量分析一体化,比传统定性PCR更为简便和快速,同时也避免了传统PCR产物分析中有害物质对人体的影响,计算和数据处理也有利于科研和临床资料的保存和分析。
3. 临床应用概要
科学研究已经证明,人类疾病大都直接或间接与基因有关,临床实验医学正进入基因诊断时代。但对于许多疾病的发生和发展来说,相关基因不是有无问题,而是一个从量变到质变的过程,基因定量检测更具有临床意义。
3.1 感染性疾病
PCR在医学检验学中最有价值的应用领域就是对感染性疾病的诊断。理论上,只要样本有一个病原体存在,PCR就可以检测到。一般实验室也能检出10~102基因拷贝,而目前病原体抗原检测方法一般需要105-7个病原体才可检测到。PCR对病原体的检测解决了免疫学检测的“窗口期”问题,可判断疾病是否处于隐性或亚临床状态。
定量PCR研究资料已表明,病原体数量与感染性疾病病情的轻重程度、传染性及治疗效果均有相关性。许多研究表明,人类免疫缺陷病毒(HIV)感染后,潜伏期长短和临床症状轻重与血液中的病毒量显著相关;有也研究表明,HIV病毒载量低于一定值时,没有传染性。
在乙型肝炎病毒、丙型肝炎病毒定量研究中发现,病毒的数量与某些药物的疗效相关。例如,干扰素治疗对肝炎病毒高拷贝者不敏感,低拷贝者敏感;而有些药物则具有显著降低病毒高拷贝的作
用。
3.2 肿瘤
尽管肿瘤发病的分子机制尚未完全清楚,但相关的基因的遗传学改变的积累,是致癌性转变的根本原因已被普遍接受。
癌基因的表达增加和突变,在许多肿瘤早期和良性的阶段就可出现。PCR技术不但能有效的检测基因的突变,而且能准确检测癌基因的表达量,可据此进行肿瘤早期诊断、分型、分期和预后判断。
几乎所有慢性骨髓性白血病患者都可检测到原癌基因易位导致的BCR/ABL融合基因形成,定量PCR技术可通过检测BCR/ABL融合基因的表达确定微量残余恶性细胞存在的数量,以此作为治疗效果和估计复发的危险性的依据。
肿瘤标记物质也是肿瘤诊断的热门研究领域。目前临床对此多用免疫学方法检测,灵敏度低,一般需要达到108个分子数。用定量逆转录(RT)-PCR方法,一般条件下可检出10-102某种标志物的mRNA,可大大提高检出率。
一些病毒致癌作用也与病毒载量有关,EB病毒载量的FQ-PCR检测结果已被用于鼻咽癌早期发现和随访。
3.3 遗传病
PCR技术首次临床应用就是从检测镰状细胞和β-地中海贫血的基因突变开始的。基因的突变和缺失均会引起各种珠蛋白的表达不平衡,用FQ-PCR检测各种珠蛋白基因表达差异,是地中海贫血诊断的有效手段。
总之,除与疾病直接相关的基因检测外,各种与疾病相关的细胞因子、激素、受体,用FQ-PCR方法检测其基因表达水平具有更高的灵敏性,更有利于疾病诊断。
参考文献
[1] Liva K J, Flood SJA, Marmaro J, et al. Oligonucletides with fluorescent dyes at
opposite ends provide a quenched prode system useful for detecting PCR product and nucleic acid hybridization. PCR Methods Applic, 1995,4:357-362.
[2] Holland PM, Abramson RD, Waston R, et al. Detection of specific polymerase chain reaction product by utilizing the 5′to 3′exonuclease activity of the
themus aquaticus DNA polymerase. Proc Nat Aca Sci USA,1991,88:7276-7280
[3] Higuchi R, Dollinger G, Walsh PS, et al. Stimutaneous amplification and
detection of specific DNA sequences. Biotechnology, 1992, 10:413-417.
广州健仑生物科技有限公司病毒研究所
徐华
2014/03/05
- 上一篇:人与人之间接触不会传播登革热(图) 2014/9/29
- 下一篇:广东省登革热病例总数已达到10743例 死亡3例 2014/9/29
